Hoher Qualitätsstandard für Covid-19 Antigen-Produkte
Während der Ausbreitung von Covid-19 haben Länder und Organisationen aus aller Welt verschiedene Covid-19-Antigen-Produkte zur Bekämpfung der Pandemie auf den Markt gebracht. Alle Covid-19-Antigen-Hersteller tun ihr Bestes, um qualitativ hochwertige Produkte zum Schutz der Gesundheit und Sicherheit aller zu entwickeln. Viele Produkte benötigen eine CE-Kennzeichnung, bevor sie in der EU verkauft werden dürfen. Das CE-Zeichen ist ein Hinweis darauf, dass ein Produkt vom Hersteller geprüft wurde und dass es alle EU-weiten Anforderungen an Sicherheit, Gesundheitsschutz und Umweltschutz erfüllt. Es ist Pflicht für alle weltweit hergestellten Produkte, die in der EU vermarktet werden.
Zuverlässige Diagnosen weltweit
FIND, die globale Allianz für Diagnostik, will einen gerechten Zugang zu zuverlässigen Diagnosen auf der ganzen Welt sicherstellen, um diagnostische Innovationen voranzutreiben und Tests zu einem integralen Bestandteil nachhaltiger, widerstandsfähiger Gesundheitssysteme zu machen. Sie führen die Studie auf der Grundlage realer klinischer Proben in verschiedenen Ländern durch. In Deutschland und der EU ist die Evaluierung durch das Paul-Ehrlich-Institut (PEI) anerkannt. Die PEI-Bewertung basiert auf gepoolten gefrorenen und in verschiedenen Konzentrationen aliquotierten Proben, nicht auf den frischen klinischen Proben.
Hintergrund FIND
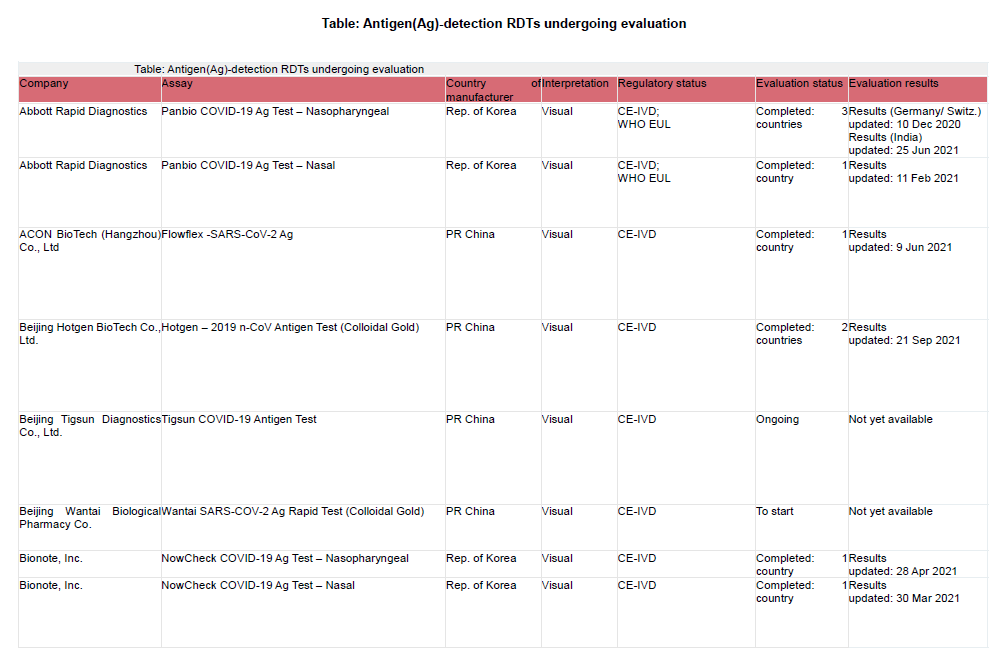
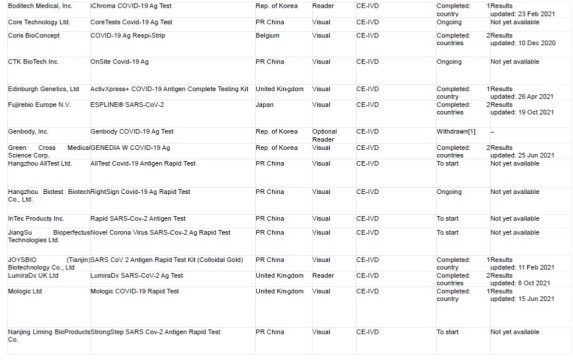
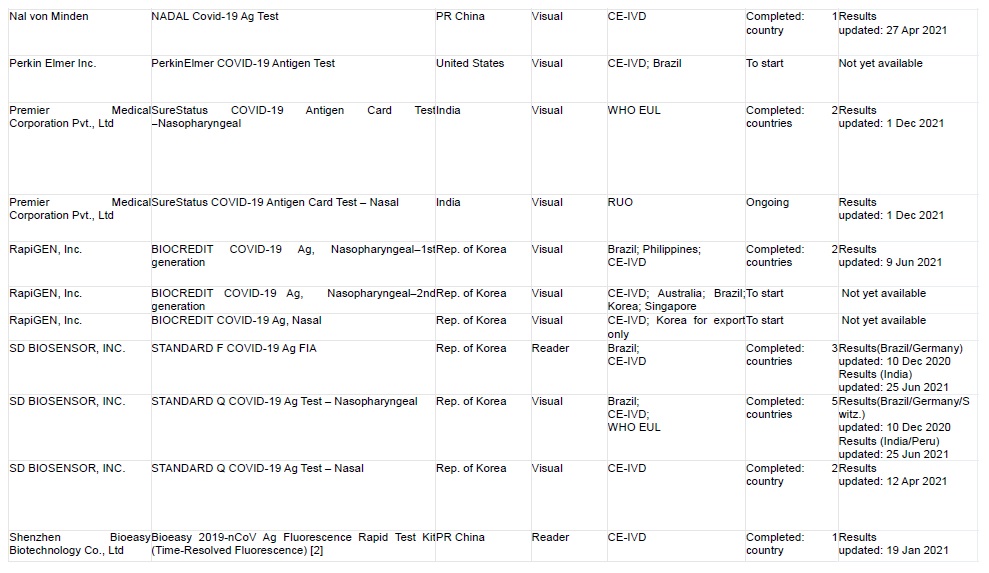
FIND führt prospektive diagnostische Evaluierungsstudien in Zusammenarbeit mit mehreren unabhängigen Einrichtungen durch, um die Genauigkeit der Covid-19-Antigen-Nachweistests (RDTs) zu bestimmen. Die eingereichten Tests wurden anhand eines Punktesystems ausgewählt, das folgende Kriterien berücksichtigt:
1) die vom Anbieter angegebene analytische Leistung
2) die vom Anbieter angegebene klinische Leistung und die Größe der entsprechenden Studienpopulation/Anzahl der positiven Covid-19 Fälle
3) Benutzerfreundlichkeit des Tests (Notwendigkeit eines Instruments, Probentyp)
4) Herstellungs- und Vertriebskapazitäten (insbesondere in Bezug auf die Fähigkeit des Unternehmens, Zugang zu LMICs Markt)
5) Regulierungsstatus – Produkte mit Zulassung durch strenge Regulierungsbehörden wie die FDA EUA oder die WHO EUL werden höher bewertet als selbst gemeldete CE-IVD-Tests, die ihrerseits höher bewertet werden als RUO-Tests
Der Status der Einreichung bei der WHO EUL oder die Zulassung bzw. das Scheitern eines anderen COVID-19-Tests wurde ebenfalls in der Endphase der Auswahl berücksichtigt. Die ausgewählten unabhängigen Standorte sind in der nachstehenden Tabelle aufgeführt (Stand 1. Dezember 2021)